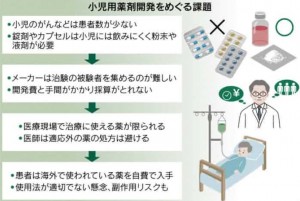
先端的な抗がん剤などが次々に登場していますが、小児用の薬がなかなか増えません。患者数が少なく、臨床試験がしづらいうえに、薬の形状や量の工夫に手間がかかり、製薬会社も敬遠しがちなっています。海外では使用できるが、日本で承認されていない薬も多くなっています。そのため、個人輸入し、用量や服用期間がわからないまま、不安を抱きながら使っている患者も少なくありません。入手できても添付文書には、子ども向けの用量の記載はなく、未承認薬のため医師も必ずしも協力的ではありません。
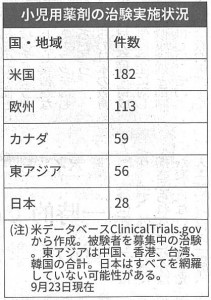
小児がんの発症は、年間2,500人前後と少なく、臨床試験の被験者を集めにくくなっています。また、低年齢だと錠剤やカプセルは服用できず、液や粉末を別途、開発する必要も出てきます。製薬会社にとって採算が合いにくく、薬が増えない状況に陥っています。このため、米欧では2000年代の初期に、成人の薬を開発する際に、小児用の治験計画も提出するよう法で義務付けています。見返りに、特許の独占実施権の延長や審査期間の短縮クーポン付与など、インセンティブを与えています。結果として、小児が使える薬は飛躍的に増えています。
(2020年9月28日 日本経済新聞)
(吉村 やすのり)