細胞からなる再生医療製品は、一般に有効性を示すのが難しいとされています。薬の場合、新薬候補と偽薬のどちらを投与するか医師や患者に知らせない方式の臨床試験で調べます。一方、再生医療の多くは手術が必要なためこうした比較ができません。治療前後を比較する方式で評価するが、客観的に有効性を示すのが困難です。対象の患者を集めるのにも手間がかかります。
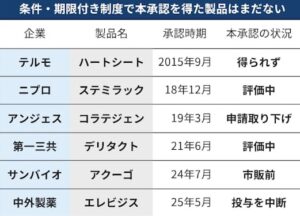
こうした特徴を考慮した再生医療製品の条件・期限付き承認制度では、限られた症例数でも安全性が承認され、有効性が推定されれば販売が認められます。これが仮免許の早期承認で、市販後に定められた期間内に使用例を調査し、効果が認められれば正式承認となります。テルモの再生医療製品であるハートシートは、製造販売の条件・期限付き承認制度で仮免許の早期承認を得ましたが、2024年7月に市販後の調査で有効性を示せず正式な薬事承認を得ることができませんでした。
有効性の評価が困難な様々な再生医療技術に対して、日本再生医療学会は自由診療で症例数を増やし、エビデンスを集積する取り組みを始めようとしています。有効性や安全性のエビデンスのある検証型診療という分類を自由診療に設ける狙いです。自由診療のクリニックなども製造受託会社を使う場合があります。安全性など品質を確保した再生医療が普及するためには、そうした企業の貢献も必要になります。
(2025年7月15日 日本経済新聞)
(吉村 やすのり)