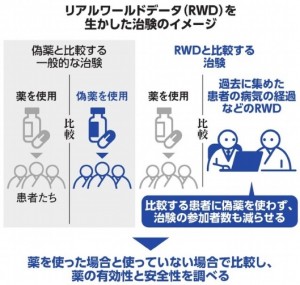
薬の開発のための治験では、通常数百~数万人規模の参加者が必要になります。薬を使う集団と、有効成分が含まれていない偽薬を使う集団とに参加者を分け、実際に使用した効果などを比較する必要があります。患者数が少ない希少疾患や難治性の病気は、臨床試験の参加者を集めるのが難しく、治療薬の開発が進みにくくなっています。また、命にかかわる病気の患者に偽薬を使うことへの倫理的な課題も指摘されています。
こうした状況で、注目されているのが日常的な診察時の医療データで、リアルワールドデータ(RWD)と呼ばれています。厚生労働省は、来年度から希少疾患や難治性の病気のRWDを集めたレジストリをつくる研究機関を4カ所ほど募集します。薬事審査を担う医薬品医療機器総合機構(PMDA)と連携し、ガイドラインをつくります。来年度の予算案に3,300万円が計上されています。
医薬品の承認審査では、有効性や安全性を調べるため、厳密なルールで集めたデータが必要となります。審査に耐えられるためには、どのようなデータを集めればよいのか、研究者にとっては不明瞭な部分が多く、ガイドラインなどの必要性が指摘されていました。
(2023年3月1日 朝日新聞)
(吉村 やすのり)