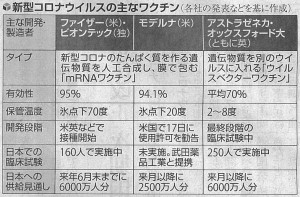
新型コロナウイルスのワクチンの承認の可否を決める審査が、日本でも始まりました。厚生労働省は、審査期間を通常の医薬品より大幅に短縮する特例承認を適用する方針です。ワクチンの開発には、通常10年以上かかります。今回の新型コロナのファイザーのワクチンは、短期間で大量に合成できる遺伝物質のメッセンジャーRNAを主成分に使う戦略が奏功し、開発から1年弱で英米などで接種にこぎつけました。
米食品医薬品局(FDA)は、利益がリスクを上回ると判断し、近く米国で接種が始まる見通しです。ファイザーのワクチンは、米国で自国民を含む4万人の大規模な臨床試験が行われ、米国では申請から3週間で使用許可が出ました。しかし、日本での臨床試験は、160人と規模が小さく、感染者が欧米と比べて少なく、ワクチンの有効性を国内で調べることは難しくなっています。
しかし、ワクチンの副作用は人種で異なる可能性があり、海外の承認データだけでは、安全性の検証が不十分です。このためわが国のFMDAは、特例承認でも国内の臨床試験のデータは重要としています。しかも、mRNAワクチンは、新型コロナ以前に実用化した例がありません。ファイザー、モデルナの臨床試験では、重い副作用の報告はかったのですが、健康な市民を対象に数十万人、数百万人と接種するには、非常にまれな副作用でも無視できません。
国は拙速に承認の可否を判断せず、海外の事例も参考に慎重に手続きを進めることが大切です。もし、重篤な副作用が出た場合には、既に臨床上有益であることが分かっているワクチン接種にも影響を与える可能性も出てきます。
(2020年12月19日 日本経済新聞)
(吉村 やすのり)