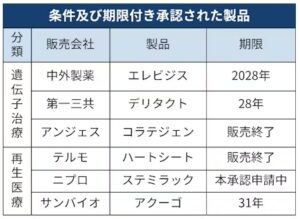
ヒトの細胞は個人差があり品質にばらつきが出ます。従来の医薬品より有効性の確認に時間を要します。このため、少数の症例による臨床試験で安全性を確認し、有効性を推定した段階で、一定の条件と期限を付けて暫定的に承認する制度があります。保険適用を認めて、発売後に有効性などを検証できれば本承認します。
2000年代に山中伸弥・京都大学教授があらゆる臓器・組織の細胞に分化できるiPS細胞を発見したことなどを背景に、政府は再生医療を国家戦略の柱に据えて2014年に条件・期限付き承認制度を設けています。第1号となったテルモの心不全向け細胞医薬のハートシートは2015年に承認されたものの、有効性を示せず2024年に販売を終えています。現在までに6製品が承認されてきましたが、iPS細胞を使った医薬品の承認は今回が初めてです。
販売後に本承認を得た製品はまだ存在していません。英科学誌ネイチャーが2019年に効果が実証されていない治療法は患者に販売されるべきでないと主張する社説を掲載するなど、制度の是非を巡る議論も起きています。
(2026年2月20日 日本経済新聞)
(吉村 やすのり)






