ドラッグ・ロスとは、欧米で承認された薬が日本で使えない事態を指します。中央社会保険医療協議会の薬価専門部会では、ドラッグ・ロスに陥っている医薬品86品目のうち39品目が、日本ではその病気に対する既存薬がないと報告されています。特定の病気に関わらず、幅広い領域でドラッグ・ロスが発生しています。
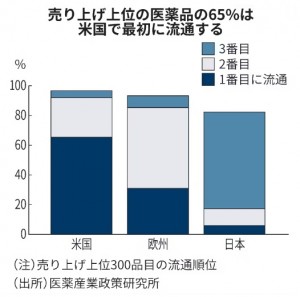
日本は薬価が低く、事業性が成り立ちにくくなっています。販売時に想定される価格が欧米に比べて低いうえに、市場に出回るほど薬価が下がるなど不確実性が高く、収益性を見込めない日本市場での開発は、検討すらされないことがほとんどです。医薬産業政策研究所によれば、2021年の世界の医薬品売り上げ上位300品目のうち65%は、米国で最初に流通します。日本で最初に流通するのは6%ほどです。
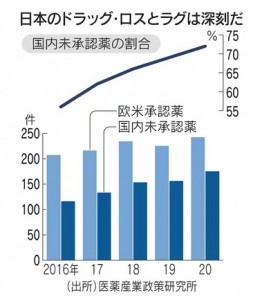
海外で使用されている医薬品の日本での承認が遅れるドラッグ・ラグも深刻になっています。2020年時点で米国とEUで承認された新薬のうち、日本では72%が未承認で、上昇傾向にあります。2009~2017年に開発された新薬で、世界で初めて承認された時期と国内承認された時期の差は54.1カ月にも達しています。韓国の28.2カ月の約2倍です。治験には、参加者を集めるコストや時間が欠かせません。グローバルな製薬会社には、この手間を嫌って日本での販売を断念したり、市場投入の時期を他国に比べ大幅に遅らせたりしています。
厚生労働省は、ドラッグ・ロスの解消に向けて、薬価上の措置を見直す議論を進めています。また、日本で薬を売り出すために、臨床試験の過程で日本人で安全性を別途確認しなければならない制度が原則廃止されます。新薬の日本での早期流通を促し、患者の不利益の解消につなげるとしています。
(2023年11月14日 日本経済新聞)
(吉村 やすのり)