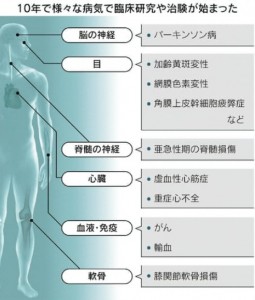
体のあらゆる組織に育ち、医療に革新を起こすとされるiPS細胞の政府の大規模プロジェクトが始まって10年が経過しました。2012年にiPS細胞を作製した京都大学の山中伸弥教授にノーベル賞が贈られると、政府は成長戦略の柱に位置付け、2013年度から10年間で関連研究に1,100億円を投じました。再生医療実現拠点ネットワークプログラムでは、中核拠点の京都大学がiPS細胞を配り、慶應義塾大学、理化学研究所など4拠点を中心に再生医療の実用化を目指しました。中核拠点には概ね年間25億~30億円、4拠点には同3億~4億円が配分され、計400億円以上を集中投資しました。
2014年に理化学研究所などが加齢に伴う目の病気である加齢黄斑変性の治療を目指した臨床研究で初めて患者に移植しました。その後、医療応用を目指して、心臓病やパーキンソン病、脊椎損傷など次々と移植研究が進みました。患者の移植で安全性の確認に目途が立った一方で、これまで治療効果を示せた例はほとんどありません。実用化までの死の谷に直面している状況です。他の治療に対する優位性を示すのには時間がかかります。革新的な医療技術の実用化には約30年かかるとされています。iPS再生医療が実用化していないといっても失望する状況ではないとの指摘もありますが、安全性の確認が進んだ現在、治療効果の検証をすべき段階にきています。
もうひとつの柱が、患者のiPS細胞から組織をつくって、病気の仕組みを調べ、効果のある薬を探し出す創薬の分野です。一部の疾患を対象に臨床試験が始まるなど、成果を上げていますが、こちらも製品として承認にこぎつけた例はまだなく、製品化への道筋は確立されていません。10年間程度で経済成長につなげるという政府の思惑には無理があったといわざるを得ません。実現までには相応の時間がかかると想定し、基礎研究を中心に着実に支援を続けていくのが国の役割と心得るべきです。
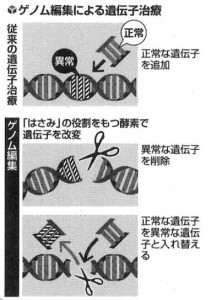
一方、iPSへの予算集中による弊害を指摘する声があったのも事実です。海外では、歴史が長いES細胞が先行する分野もあります。2012年には遺伝子の配列を自在に改変できる新しいゲノム編集の新たな技術が開発され、iPS細胞のゲノム編集もさまざまに試みられています。新しい技術の導入や組み合わせなど、視野を広く保ち、柔軟に戦略を練る必要があります。とりわけ海外から遅れているのが、正常な遺伝子を外部から導入する遺伝子治療の分野です。実用化まで30年以上の月日を要しましたが、海外で開発された治療薬が日本でも承認され始めています。
欧米では、体内に外から遺伝子を送り込んで難病やがんを治す遺伝子治療が、急速に実用化されています。治療法がない病気の克服につながると期待されていますが、日本は独自の開発や治験が進んでいません。狙った遺伝子を効率良く改変できるゲノム編集技術を応用した医療も、実現が迫っています。ゲノム編集は、遺伝子の配列をはさみのように切り取る酵素を使い、簡単に配列の削除や入れ替えができます。高効率で簡単に改変できるクリスパー・キャス9という技術が報告された2012年以降、研究が活発化しています。遺伝子治療は、治験で狙い通りの効果が得られないことが多いなど技術的な課題も残っています。患者数が少なく、薬価が高額になる点も問題です。
海外では、NIHが年間1,000億円規模をiPS細胞関連研究に投じ、病気のメカニズム解明など幅広く支援しています。日本のようにiPS細胞の再生医療に特化した研究プロジェクトは海外では見あたりません。iPS細胞への予算の集中による弊害を指摘する声も上がっています。海外で再生医療と言えば、1990年代からの蓄積があるES細胞を使うことが多くなっています。世界的な金融の引き締めもあり、2022年の世界での再生医療分野のバイオベンチャーへの投資は、2021年比で約4割減っています。これまで再生医療に対しては多額の投資がなされ、様々な臨床研究が開始されていますが、これまで明らかな治験成績の向上はみられず、臨床応用が進んでいるとは思われません。治験、承認、安定生産、研究開発への再投資というサイクルには到達しておりません。研究開発と事業化の間にある死の谷を乗り越えられるか否かはこれからにかかっています。
(2023年7月21日 日本経済新聞)(2023年7月12日 読売新聞)
(吉村 やすのり)