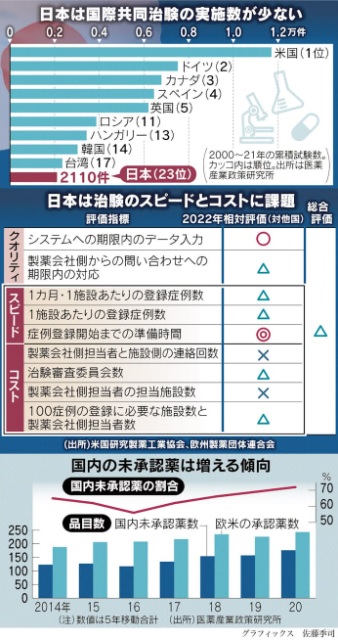
わが国は、以前より薬の実用化に必要な臨床試験の体制に課題があり、世界で生まれる画期的な新薬の7割が、日本で治療に使えない事態となっています。製薬会社や医療機関が必要な数の被験者を即座に集めることができず、欧米に比べて長期化しやすい状況にあります。治験の費用もかさむため、国際共同治験の対象国から外される例もあり、国内の難病患者の不利益となっています。
1つの薬の基礎研究から国の承認までの開発期間は、一般的に9~17年程度とされています。治験は実際にヒトに投与し、安全性と有効性を確認する開発の最終段階に当たります。実施期間は3~7年で、一定数の健常者や患者の協力が必要となります。欧米の製薬大手各社が指摘する問題点が、治験の進めにくさとコストの高さです。
元々日本では、治験に参加したいという患者が少なくいことも問題です。安全性への根強い不安に加え、国民皆保険を実現している独自の公的医療保険制度が背景にあります。欧米は保険の未加入者が存在します。治験は、高額となる高度医療を無料で受けるための一つの手段とみなす傾向があります。一方、日本は保険でカバーされるため、個人の医療費負担が比較的軽くなっています。治験に参加したいというインセンティブが起きにくい状況にあります。
医薬産業政策研究所によれば、2000~2021年に日本が参加した国際共同治験の数は累計で2,110で、世界で23位にとどまっています。直近5年間に欧米で承認された新薬のうち、72%が日本で未承認でした。日本の医薬品市場は、米国や中国に次ぐ世界3位の規模にもかかわらず、海外で使われている新薬が日本で生かせないドラッグ・ロスの問題がかねて指摘されています。
治験後進国の現状を打破するため、DXの活用が期待されています。従来の治験は都市部に集中していました。地方にいる患者にも裾野を広げる手段として有望なのが、遠隔地からも治験に参加できるリモート治験です。安全性の担保や個人情報の取り扱いなどで課題は残るものの、日本の治験のあり方を考える機会になります。
(2024年4月29日 日本経済新聞)
(吉村 やすのり)