欧米で使える薬に関して、国内では数年遅れで承認されるドラッグ・ラグや、開発すらされず永遠に使えないドラッグ・ロスが大きな問題となっています。多くを占めるのは小児や希少疾患用の医薬品です。日本製薬工業協会によれば、今年3月時点で、143品目の薬が欧米では使えるのに国内では未承認です。特に、小児や希少疾病用の薬の開発が進んでいません。高額な薬を個人輸入して自己責任で使うことを考える家族もいるのが現状です。製薬企業に小児用医薬品を開発しない理由について聞いたアンケートでは、採算が取れない、治験が困難、患者が少ないなどの理由が挙げられています。
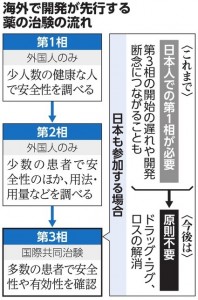
厚生労働省も、ドラッグ・ラグなどの解消に向けた取り組みを進めています。海外で開発が先行する医薬品の国内での開発を促すために、薬の臨床試験の仕組みを改善しています。これまでは国際共同治験の参加前には、日本人での安全性を調べる第1相試験が必要でしたが、今後は原則必要としません。
これまでは、海外で開発が進み、第3相段階の国際共同治験に日本が参加する場合も、日本人での第1相試験が必要とされてきました。時間や費用がかかり、日本での開発の遅れや、海外企業の日本での開発断念につながっていました。希少疾患や小児用などの医薬品を想定しています。企業が、成人用と同時に小児用の薬も開発しやすくなるような優遇措置も検討しています。
(2023年10月18日 朝日新聞)
(吉村 やすのり)