厚生労働省によれば、3月時点で米国では小児への使用が承認されている40の抗がん剤のうち、日本では6割の24剤が未承認です。特に16剤は、日本では成人向けに承認されているのに、小児では認められていません。
米国では、遺伝子異常のタイプで使い分けてがん細胞を狙い撃ちする有効性の高い分子標的薬を成人向けに開発する場合には、小児向けもあわせて開発することが2017年に義務付けられています。EUでも小児向けの開発を義務付けています。日本は高い薬価がつきにくく、薬の開発費をカバーすることができず、薬の承認が遅れ、ドラッグ・ラグが生じています。小児の治験をできる医療機関も限られています。
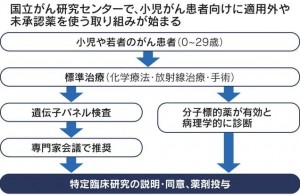
海外で使えるのに日本では薬の承認が遅れる小児がんのドラッグ・ラグ改善に向け、国立がん研究センター中央病院が特定臨床研究を始めます。北海道大学も取り組んでいます。未承認薬などを患者が使える制度を活用した取り組みで、海外との格差是正に期待が集まっています。
国立がん研究センターは、患者申出療養制度を活用し、患者が治療を受けられる体制を構築しています。国内では未承認の薬などを公的医療保険が適用される診療と組み合わせて治療でき、患者の金銭的負担を軽減できます。薬剤ごとに最大30人の患者が参加でき、効果や安全性を調べます。がん患者の全遺伝情報を調べるがん遺伝子パネル検査などで治療薬が推奨された薬を投与します。薬剤は製薬会社から提供され、公的研究費で運営します。特定臨床研究の部分で患者の金銭的負担はありません。
(2023年11月11日 日本経済新聞)
(吉村 やすのり)